Artículos
El manejo de la coccidiosis en las reproductoras pesadas: 1
09 June 2015Los objetivos de la prevención de la coccidiosis en las reproductoras consiste en conferir una protección fuerte, uniforme y duradera contra la enfermedad clínica durante todo el ciclo productivo. (Primera parte de una serie de dos artículos)
 Artículo del Dr. Héctor Cervantes, de Phibro Animal Health presentado en la Conferencia de Avicultura de Reproducción de Carolina del Norte, EUA, 2014.
Artículo del Dr. Héctor Cervantes, de Phibro Animal Health presentado en la Conferencia de Avicultura de Reproducción de Carolina del Norte, EUA, 2014.
La coccidiosis es una parasitosis frecuente de los pollos de engorde y de sus reproductoras, causada por protozoos parásitos del género Eimeria comúnmente llamados coccidias.
Dos son los tipos de coccidiosis. Las aves afectadas por la forma clínica presentan los síntomas característicos de la enfermedad, como deyecciones sanguinolentas y mortalidad elevada. Por su parte, la forma subclínica recibe ese calificativo porque las aves no presentan síntomas visibles de la enfermedad, pero el examen de una muestra de ejemplares escogidos al azar revela la presencia de lesiones macroscópicas y del propio parásito.
Los objetivos de la prevención de la coccidiosis difieren según se trate de los pollos de engorde o de las futuras reproductoras. En los primeros, lo primordial es impedir la pérdida de rendimiento en el lote causada por la infección, en tanto que en las segundas consiste en conferir una protección fuerte, uniforme y duradera contra la enfermedad clínica durante todo el ciclo productivo.
La coccidiosis en las reproductoras pesadas
El ciclo productivo de las reproductoras pesadas supera de largo el de los pollos destinados al consumo, por lo que la estrategia de prevención contra la coccidiosis ha de ser distinta. En las pollitas destinadas a ser las reproductoras el objetivo consiste en asegurar el desarrollo de una inmunidad protectora y duradera contra las principales especies de Eimeria que pueden afectarlas en la edad adulta. Por ello, en la solución mayoritaria para la prevención de la coccidiosis en EUA. consiste en la vacunación de las pollitas reproductoras en la misma sala de nacimiento (4).
El objetivo es conferir una protección sólida y uniforme contra la coccidiosis tan pronto como sea posible. La capacidad para desencadenar una respuesta inmunitaria satisfactoria depende de la especie de coccidia: en el caso de las especies más inmunógenas (las que generan inmunidad con rapidez) como E. maxima, bastan dos ciclos completos del parásito para inducir la protección adecuada, mientras que en las menos inmunógenas, como E. necatrix, pueden ser necesarios cuatro ciclos para conseguir el mismo grado de protección.
No todas las aves ingieren la dosis completa de vacuna contra la coccidiosis en su primer día de vida, por lo que en general se acepta que la protección debe ser completa entre la 10ª y la 12ª semana de vida, de modo que ya no sea necesario volver a tratar los lotes a partir de ese momento.
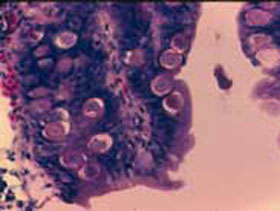 El ciclo vital del coccidio
El ciclo vital del coccidio
Los coccidios aviares tienen un ciclo de vida directo que consta de una fase externa, que transcurre fuera del cuerpo del ave (estadio de huevo) y dos fases internas (estadios parasitarios).
Los pollos quedan infectados por la ingesta de ooquistes esporulados del coccidio (huevos infecciosos). En las pollitas reproductoras, los huevos esporulados generalmente se aplican en forma de vacuna atenuada dentro de una cabina de rocío (espray), en la sala de nacimiento en la planta de incubación. Las pollitas ingieren los huevos cuando se arreglan el plumaje tras el rocío de la vacuna. Este acicalamiento es una conducta instintiva con la que se mantiene el plumaje limpio, seco y engrasado.
Es posible fomentar el acicalamiento añadiendo un colorante a la vacuna rociada; las pollitas responden bien a colores como el azul, el verde o el rojo, que ofrecen los mejores resultados con ese propósito. Otra ventaja del colorante es que el personal de la sala puede comprobar a simple vista la cobertura lograda con el rocío y valorar la eficacia del proceso.
A pesar de que los colorantes estimulan el acicalamiento y, por ende, la ingesta de la vacuna anticoccidiana, el método más eficaz para fomentarlo consiste en aumentar durante unos minutos la intensidad lumínica tras la pulverización de la vacuna. Un avicultor dedicado a la selección instauró con éxito un programa de estimulación del acicalamiento y de la ingesta de la vacuna en su sala de nacimientos que consistía en aumentar la intensidad lumínica hasta unos 1.000 lux durante los seis minutos siguientes al rocío de la vacuna (5).
Solo los huevos esporulados tienen capacidad infecciosa, por lo que las vacunas vivas destinadas a las pollitas reproductoras contienen una cantidad prefijada de ooquistes esporulados de las diversas especies de coccidio; la cantidad añadida de cada especie en principio debe ser suficiente para desencadenar una respuesta inmunitaria satisfactoria.
Todo ello es importante porque si se pretende generar una inmunidad potente el ave ha de ingerir los ooquistes esporulados, estos han de multiplicarse en el intestino cierto número de veces y ser excretados con las deyecciones en forma de ooquistes sin esporular, para después –si se dan las condiciones adecuadas de humedad, temperatura y oxígeno– sufrir la esporulación en la cama, desde donde volverán a ser ingeridos hasta repetir el ciclo varias veces, proceso que culminará en la inmunización del ave.
Estudios previos (6) indican que las condiciones más adecuadas para la esporulación de los ooquistes en las naves van de los 20 a los 32 °C de temperatura y del 30 al 40 por ciento de humedad.
La intensidad de la infección se controla a través de la potencia de la vacuna que se administra en la sala de nacimientos, que debe ser suficiente para propiciar la multiplicación del parásito y desencadenar la inmunidad del ave sin causarle la muerte ni síntomas graves (8).
Coccidios importantes en las reproductoras
Las especies de coccidios que afectan a las reproductoras de engorde son nueve (9), pero las responsables de la mayoría de problemas suelen ser cuatro: E. acervulina, E. maxima, E. necatrix y E. tenella (10,11).
Cada especie de coccidio muestra predilección por un segmento del intestino. Así por ejemplo, las lesiones causadas por E. acervulina se localizan en el tramo superior del intestino delgado (el duodeno), las de E. maxima y E. necatrix se concentran en el tramo central de dicho intestino (el yeyuno) y las de E. tenella en los ciegos.
Es importante averiguar el tipo de coccidios que están afectando al lote puesto que la respuesta al tratamiento puede variar. Las especies intestinales (E. acervulina y E. maxima) son más sensibles a las sulfamidas, mientras que las hemorrágicas (E. necatrix y E. tenella) lo son más al amprolio (10,11).
Bibliografía
1. Cervantes, H. 2002. Incidence of pathological conditions in clinically normal broilers from different regions of the USA. 51st Western Poultry Disease Conference, May 1-4, Casa Magna Marriott Resort, Puerto Vallarta, Jalisco, Mexico, p220-223.
2. Cervantes, H. 2006. Incidence of subclinical diseases and pathological conditions in clinically normal broilers from 3 production complexes sorted by sex and age. 143rd Annual Convention of the American Veterinary Medical Association and 50th Annual Meeting of the American Association of Avian Pathologists, July 15-19, Hawaii Convention Center, Honolulu, Hawaii.
3. Mathis, G.F. and C. Broussard, 2006. Increased level of Eimeria sensitivity to diclazuril after using a live coccidial vaccine. Avian Dis. 50:321-324.
4. Mosizek, B., M. Burlenson, I. Alvarado, L. Newman, J. Radu and S. Fitz-Coy, 2014. Recommendations for effective coccidiosis vaccination: An update on pullet and cockerel management. Annual Meeting of the American Association of Avian Pathologists, July 26-29. Convention Center, Denver, Colorado.
5. Anonymous. Shedding light on spray cabinet vaccination. Cocci Forum, number 11. p4-6.
6. Frazier, M.N., 1987. Controlling coccidiosis in replacements. Poultry Digest, September. p380-383.
7. Cervantes, H.M. 2008. Coccidiosis Control. Proc. North Carolina Broiler Supervisor's Short Course. April 17, McSwain Extension Center, Sanford, North Carolina.
8. Chapman, H.D. Technically Speaking: Essential Elements. Cocci Forum #12. p14-15.
9. McDougald, L.R. and S.H. Fitz-Coy. 2008. Coccidiosis, in: Diseases of Poultry, 12th Ed. Iowa State University Press. p1068-1085.
10. Bafundo, K. 1995. The use of live coccidial vaccines in broiler breeder pullets. Ross Tech, October 1995.
11. Hofacre, C.L. Combating coccidiosis in broiler breeders. Cocci Forum #6. p15-17,26.
12. Johnson, J. and W.M. Reid. 1970. Anticoccidial drugs: Lesion scoring techniques in battery and floor-pen experiments with chickens. Exp. Parasitol. 28: 30-36.
También le interesaría
Video: Importancia de la coccidiosis subclínica
Junio 2015

 © 2000 - 2021. Global Ag MediaNinguna parte de este sitio puede ser reproducida sin previa autorización.
© 2000 - 2021. Global Ag MediaNinguna parte de este sitio puede ser reproducida sin previa autorización.