Artículos
Hormona liberadora de las gonadotropinas y su rol en fisiología reproductiva aviar
11 January 2016Se reconoce a la hormona liberadora de las gonadotropinas o GnRH, como el principal agente regulador de las funciones reproductivas.

Abrieviación del artículo de María del Carmen Revelo, Universidad Central del Ecuador y Daniel Lombardo, y Juan Alberto Claver, Universidad de Buenos Aires - Argentina.
En todos los vertebrados, incluyendo las aves, los procesos reproductivos tienen como sistema básico de control al eje hipotálamo-hipófisis-gonadal. Dentro de este eje ha sido bien establecido que la hormona hipotalámica, GnRH (hormona liberadora de las gonadotropinas) ejerce un papel fundamental en el control de la reproducción (Ottinger & Bakst, 1995; Krishnan et al., 1993).
En las aves, sólo existe información relacionada con las funciones centrales de GnRH sobre la hipófisis y su relación con la liberación de gonadotrofinas (Krishnan et al., 1993; Millar & King, 1983; Miyamoto et. al., 1984; Sharp et al. 1990).
Características estructurales de la hormona GnRH
La hormona liberadora de gonadotropinas o GnRH (por sus siglas del inglés, Gonadotrophin Realeasing Hormone) es un decapéptido que se sintetiza en el hipotálamo como una pro-hormona de 92 aminoácidos (Flanagan et. al., 1997; Ortmann & Diedrich, 1999; Wetsel & Srinavasan, 2002).
La pro-hormona se cliva proteolíticamente para generar cuatro estructuras: péptido señal (23 aminoácidos); la hormona GnRH (diez aminoácidos); un sitio de procesamiento proteolítico (tres aminoácidos, Gly-Lys-Arg); y una proteína asociada a GnRH (GAP, que posee 56 aminoácidos) (Chan et. al., 2009; Millar et. al., 2004; Quintana & Flores, 2011; Wetsel & Srinavasan, 2002).
La disposición espacial del péptido correspondiente a GnRH, separado de la proteína GAP por un sitio de procesamiento proteolítico sugiere que las enzimas que procesan la pro-GnRH pueden ser similares en todas las especies (Wetsel & Srinavasan, 2002).
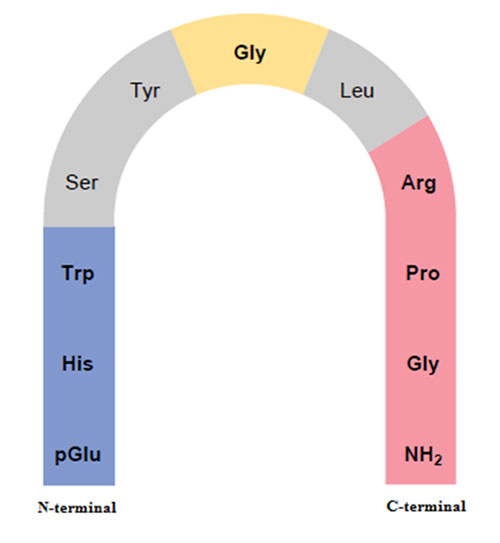
La forma biológicamente activa de la GnRH contiene una curvatura en la porción media de la molécula que facilita que los extremos carboxi terminal y amino terminal se acerquen y activen el receptor de GnRH (figura 1) (Flanagan et. al., 1997, Karten & Rivier, 1986; Prieto & Velásquez, 2002).
En el pollo (Gallus galllus domesticus) se han identificado dos isoformas de GnRH: cGnRH-I y cGnRH-II (Sharp et. al., 1990). La isoforma cGnRH-I difiere sólo en el aminoácido de la posición 8 con respecto a la mGnRH (Ubuka & Bentley, 2011).
El receptor para GnRH
El receptor para GnRH, GnRH-R, es miembro de la familia de receptores acoplados a proteína G (GPCR). Estos receptores se componen de un única cadena de aminoácidos que poseen un dominio amino terminal extracelular y siete segmentos hidrofóbicos (siete dominios transmembrana) que forman α hélices que atraviesan la membrana y conectan con bucles extra e intracelulares (Flanagan et. al. 1997; Ortmann & Diedrich, 1999; Ramakrishnappa et. al. 2005).
En las aves, específicamente en la gallina doméstica existen dos subtipos de receptores para GnRH, cGnRH-R-I y cGnRH-R-III (Joseph et. al., 2009). La clonación del cGnRH-R-I se llevó a cabo por Dunn y colaboradores (1993) a partir ARN del hipotálamo de pollos. El papel de los dos tipos de receptores, fue luego diferenciado por clonación y comparación de estructuras y propiedades farmacológicas. Los resultados de esta última investigación proponen que el cGnRH-R-III es probablemente el principal mediador de la función de la GnRH en la pituitaria del pollo (Joseph et. al., 2009).
La distribución y localización de los tipos de GnRH y sus receptores fuera del eje hipotálamo-hipófisis han sido poco estudiados en las aves, aunque en el gallo se han identificado a la cGnRH I y al GnRH-R-I, en órganos como testículos, bazo, riñones y corazón (Sun et. al., 2001a).
En aves silvestres, se determinó la presencia de la hormona GnRH-I y su receptor (GnRH-R-I) por inmuhistoquímica, slot/western blot e inmunoblotting, en las células de la granulosa y teca de los folículos previtelogénicos y vitelógenicos del Bengalí rojo (Amandava amandava) (Padmasana et. al., 2007).
Fisiología de la hormona GnRH en las aves
La hormona GnRH es una hormona que secretándose de manera pulsátil, actúa a nivel de receptores hipofisarios. La unión de la GnRH con su receptor provoca la liberación de las gonadotrofinas (Prieto & Velásquez, 2002). La acción de la GnRH sobre las células hipofisiarias está mediada por mecanismos dependientes de calcio/calmodulina (Calderón & Tresguerres, 2008).
La hormona luteinizante (LH) y la hormona folículo estimulante (FSH) son las gonadotropinas sintetizadas en la hipófisis, cuya liberación es regulada por la GnRH. (Ubuka & Bentley, 2011). La hormona FSH controla el desarrollo y diferenciación folicular, mientras que la ovulación es regulada básicamente por la LH (Decuypere et. al., 1999).
Tanto la FSH como la LH actúan sobre receptores de la granulosa y la teca de los folículos ováricos de las aves, influyendo en la producción de esteroides sexuales (estrógenos y progesterona) (Ubuca & Bentley, 2011).
En consecuencia, la GnRH es el principal regulador de las funciones reproductivas en las aves, debido a que controla indirectamente la secreción de las hormonas esteroidales y la producción de gametos (Ottinger & Bakst, 1995; Padmasana et. al., 2007; Prieto & Velásquez, 2002).
Empleo de análogos de la GnRH en las aves
El conocimiento de la secuencia peptídica de la GnRH ha permitido desarrollar compuestos químicos cuya estructura semejante a dicha hormona (análogos) les permite tener una acción similar a la originada naturalmente por la hormona (agonistas) o un efecto opuesto (antagonistas).
Los agonistas de GnRH tienen un D-aminoácido en la posición 6 y/o 10 que aumenta la estabilidad frente a la degradación enzimática, incrementado además su vida media y afinidad al receptor (Husulak, 2012). La afinidad de los agonistas de GnRH aumenta gracias a la introducción en el sexto aminoácido de residuos hidrofóbicos; mientras más hidrófobo es el aminoácido, mayor es la afinidad al receptor (Karten & Rivier, 1986).
Dentro de los agonistas más comúnmente utilizados está el acetato de leuprolide (LA), que presenta D-Leucina en la posición 6 y etilamina en la posición 10 (figura 2).

Conclusiones
La hormona GnRH es un decapéptido con tres tipos moleculares diferentes y 14 variantes estructurales (Ramakrishnappa et. al. 2005; Kuo et. al., 2005). Las isoformas cGnRH-I y GnRH-II son propias de las aves y actúan tras su unión con receptores específicos. La gallina doméstica posee dos subtipos de receptores para GnRH, cGnRH-R-I y cGnRH-R-III (Joseph et. al., 2009).
La unión de la GnRH con sus receptores a nivel hipofisario provoca la liberación de las gonadotrofinas, LH y FSH (Prieto & Velásquez, 2002). En las aves, tal y como en los mamíferos, la secreción de gonadotrofinas, estimulada por la GnRH, regula de manera central y principal la fisiología reproductiva (Ottinger & Bakst, 1995; Millar et. al., 1986; Padmasana et. al., 2007).
La liberación de LH y FSH, por acción de la hormona GnRH, ha sido comprobada in vitro e in vivo, tanto en aves silvestres (gorrión de corona blanca y el estornino tinto), como en aves domésticas (gallos domésticos, pavos y codornices) (McNaughton et. al., 1995; Osugi et. al., 2004; Wingfield et. al, 1979; Connolly & Callard, 1987; You et. al., 1995; Hattori et al., 1985; Krishnan et al., 1993; Soñez et. al., 2009).
En las aves, se conoce la presencia de receptores extra-hipotalámicos para GnRH, pero las acciones directas que tiene a nivel de testículos y ovarios son inciertas. Sin embargo, en experimentos in vitro, se ha verificado su influencia sobre la mayor concentración de gonadotropinas y fibronectina en los medios de cultivo de células de granulosa ovárica, tratados con GnRH (Hertelendy et al., 1982; Asem & Novero, 1993).
A pesar que los análogos de GnRH se usan frecuentemente en regímenes de tratamientos correctivos o curativos en la práctica veterinaria, en las aves se emplea estos derivados sintéticos para el tratamiento enfermedades muy particulares como la puesta crónica de huevos de las aves ornamentales (Molenda, 2006). No obstante, en general, su uso se limita a las aplicaciones científicas de investigación para estudiar la acción fisiológica de la hormona o de sus receptores.
Bibliografía
Asem, E.K, Novero. R, P. (1993). Chicken gonadotropin-releasing hormones enhance soluble and insoluble fibronectin production by granulosa cells of the domestic fowl in vitro. Poultry Science, 72 (10), 1961-1971.
Calderón, M.D., Tresguerres, J.A. (2008). Factores que actúan en el eje hipotálamo-hipofisiario. Farmacología del tiroides. En: Velásquez et. al. (Ed.) Farmacología básica y clínica (pp. 603-619). Buenos Aires-Argentina: Editorial Médica Panamericana.
Chan, Y.M., Guillebon, A., Lang-Muritano, M., Plummer, L., Cerrato F., Tsiaras, S.,…Seminara, B. (2009). GnRH1 mutations in patients with idiopathic hypogonadotropic hypogonadism. Proceedings of the National Academy of Sciences, 106 (28), 11703-11708
Connolly, P.B., Callard, I.P. (1987). Luteinizing Hormone Secretion from the Quail Pituitary in Vitro. Biology of Reproduction, 36, 1238-1246.
Decuypere, E., Bruggeman, V., Onagbesan, y O., Safi, M. (1999). Endocrine Physiology of Reproduction in the Female Chicken: Old Wine in New Bottles. International Congress on Bird Reproduction. Francia.145-153.
Dunn I. C., Chen Y., Hook C., Sharp P. J., y Sang H. M. (1993). Characterization of the chicken preprogonadotrophin-releasing hormone-I gene. Journal of Molecular Endocrinology, 11, 19–29
Flanagan, C.A., Millar, R.P., y Illing, N. (1997). Advances in understanding gonadotrophin-releasing hormone receptor structure and ligand interactions. Reviews of Reproduction, 1997(2), 113-120.
Hattori, A., Ishii, S., Wada, M., Miyamoto, K., Hasegawa, Y., e Igarashi, M. (1985). Effects of chicken (Gln8) - and mammalian (Arg8)-luteinizing hormone-releasing hormones on the release of gonadotrophins in vitro and in vivo from the adenohypophysis of Japanese quail. General and Comparative. Endocrinology, 59, 155-161
Hertelendy, F., Lintner, F., Asem, E.K., Raab, B. (1982). Synergistic effect of gonadotrophin releasing hormone on LH-stimulated progesterone production in granulosa cells of the domestic fowl (Gallus domesticus). General and Comparative Endocrinology, 48, 117-122.
Husulak, A. Farmacología de la Reproducción-Capítulo 18. TEMAS DE FARMACOLOGÍA (Malgor-Valsecia)-Cátedra de Farmacología Facultad de Medicina UNNE. 2012. Disponible en: URL: http://med.unne.edu.ar/catedras/farmacologia/temas_farma/volumen5/18_reproducc.pdf.
Joseph, N.T., Morgan, K., Sellar, R., McBride, D., Millar, R., y Dunn, I.C. (2009). The chicken type III GnRH receptor homologue is predominantly expressed in the pituitary, and exhibits similar ligand selectivity to the type I receptor. Journal of Endocrinology, 202(1), 179–190.
Karten, M.J., Rivier, J.E. (1986). Gonadotropin-releasing hormone analog design. Structure–function studies toward the development of agonists and antagonists: rationale and perspective. Endocrine Reviews, 7, 44–66.
Krishnan, K.A, Proudman, J.A., Bolt, D.J., y Bahr, J.M. (1993). Development of a homologous radioimmunoassay for chicken follicle-stimulation hormone and measurement of plasma FSH during the ovulatory cycle. Physiology of Comparative Biochemistry andPhysiology., 105, 729-734.
Kuo, M.W., Lou, S.W., Postlethwait, J., y Chung, B.C. (2005). Chromosomal organization, evolutionary relationship, and expression of zebrafish GnRH family members. Journal of Biomedical Science. 12(4), 629-39.
McNaughton, F.J., Dawson, A., Goldsmith, A.R. (1995). A comparison of the responses to gonadotrophin-releasing hormone of adult and juvenile, and photosensitive and photorefractory European starlings, Sturnus vulgaris. General and Comparative Endocrinology, 97, 135-144.
Millar, R.P., Zhi-Liang, L., Pawson, A.J., Flanagan, C.A., Morgan, K., y Maudsley, S.R. (2004). Gonadotropin-releasing hormone receptors. Endocrine Reviews, 25(2), 235-275.
Millar, R.P., King, J.A. (1983). Synthesis and biological activity of [D-Trp6] chicken luteinizing hormone-releasing hormone. Peptides, 4, 425-429.
Miyamoto. K., Hasegawa, Y., Mamura, M., Igarashi, M., Kangawa, K., y Matsuo, H. (1984). Identification of the second gonadotropin-releasing hormone in the chicken hypothalamus: evidence that gonadotropin secretion is probably controlled by two distinct gonadotropin-releasing hormones in avian species. Proceedings of the National Academy of Sciences, 81, 3874-3878.
Molenda, SL. Lupron and its use in Avian Medicine. The Parrotlet Rach. 2006. Disponible en: URL: http://www.parrotletranch.com/lupron.html.
Ortmann, O., y Diedrich, K. (1999). Pituitary and extrapituitary actions of gonadotrophin-releasing hormone and its analogues. Human Reproduction, 14(1), 194-206.
Osugi, T., Ukena, K., Bentley, G.E., O’Brien, S., Moore, I.T., Wing?eld, J.C., y Tsutsui, K. (2004). Gonadotropin-inhibitory hormone in Gambel’s white-crowned sparrows: CDNA identi?cation, transcript localization and functional effects in laboratory and ?eld experiments. Journal of Endocrinology, 182, 33–42.
Ottinger, M.A., Bakst, M.R. (1995). Endocrinology of the Avian Reproductive System. Journal of Avian Medicine and Surgery, 9(4), 242-250.
Quintana, J.C., Flores, C. (2011). Antagonistas de GnRH en reproducción humana. Tendencias en Medicina, 38,67-72.
Padmasana, S., Krishna, A., Sridaran, R. (2007). Localization of gonadotrophin-releasing hormone I, bradykinin and their receptors in the ovaries of non-mammalian vertebrates. Society for Reproduction and Fertility, 133, 969–981.
Prieto, B., Velázquez, M. (2002). Fisiología de la reproducción: hormona liberadora de gonadotropinas. Revista Facultad de Medicina de UNAM. 45(6), 252-257.
Ramakrishnappa, N., Rajamahendran, R., Lin, Y.M., y Leung, P.C. (2005). GnRH in non-hypothalamic reproductive tissues. Animal Reproduction Science. 88(1), 95-113.
Sharp, P.J., Talbot, R.T., Main, G.M., Dunn, I.C., Fraser, H.M., y Huskisson, N.S. (1990). Physiological roles of chicken LHRH-I and -II in the control of gonadotrophin release in the domestic chicken. Journal of Endocrinology, 124(2), 291-299.
Soñez, M.C., Soñez, C.A., Mugnaini, M.T., Haedo, M., Romera, S.A., Lombardo, D.M. y Delhon, G.A. (2010). Effects of differential pulse frequencies of chicken gonadotrophin-releasing hormone-I (cGnRH-I) on laying hen gonadotrope responses in vitro. Biotechnic and Histochemestry, 85(6), 355-63.
Sun, Y.M., Dunn, I.C., Baines, E., Talbot, R.T., Illing, N., y Millar, R.P. (2001a). Distribution and regulation by oestrogen of fully processed and variant transcripts of gonadotropin releasing hormone I and gonadotropin releasing hormone receptor mRNAs in the male chicken. Journal of Neuroendocrinology, 13, 37-49.
Ubuka, T., Bentley, G.E. (2011). Neuroendocrine Control of Reproduction in Birds. En: Norris, D. y López, H. (Ed.). Hormones and Reproduction of Vertebrates (pp. 6-25). San Diego, United States of America: Elsevier Inc.
Wetsel, W.C., y Srinivasan, S. (2002). Pro-GnRH processing. Progress in Brain Research, 1(41), 221-241.
Wingfield, J.C., Crim, J.W., Mattocks, P.W., y Farner, D.S. (1979). Responses of photosensitive and photorefractory male white-crowned sparrows (Zonotrichia leucophrys gambelii) to synthetic mammalian Luteinizing hormone releasing hormone (syn-LHRH). Biology of Reproduction, 21, 801-806.
You, S., Foster, L.K., Silsby, J.L., El Halawani, M.E., y Foster, D.N. (1995). Sequence analysis of the turkey LH beta subunit and its regulation by gonadotrophin-releasing hormone and prolactin in cultured pituitary cells. Journal of Molecular Endocrinology, 14, 117-129.
También le interesaría
Apareamiento y reproducción natural
Enero 2016

 © 2000 - 2021. Global Ag MediaNinguna parte de este sitio puede ser reproducida sin previa autorización.
© 2000 - 2021. Global Ag MediaNinguna parte de este sitio puede ser reproducida sin previa autorización.